Innovación en la regulación de las digital health terapéuticas: un reto europeo en beneficio de los pacientes
<p>Los dos años de pandemia han sido clave para acelerar la digitalización del sector salud y de los servicios de atención sanitaria, así como para impulsar las <em>startups</em> de<em> <a href="https://www.digital.health/digital-health-landscape" target="_blank">digital health</a>. </em>La innovación en la adopción de tecnología en la prestación de los servicios sanitarios y hacer que éstos acaben llegando a las personas son todavía retos de antemano. En este sentido, Cataluña apuesta por contar con una <strong>autoridad notificadora que asesore y acompañe a las terapias digitales de la BioRegión durante su proceso de integración dentro del sistema</strong></p>

La BioRegión ha experimentado un importante crecimiento de estas de empresas en los últimos diez años, tanto en número como en inversión captada, tal y como muestra el Informe de la BioRegión de Cataluña 2021, presentado el mes pasado. Dentro de este subsector encontramos la categoría de productos digital therapeutics (DTx), soluciones tecnológicas digitales (software) evaluadas clínicamente, que ofrecen intervenciones terapéuticas que impactan directamente en los pacientes, que cuentan con evidencia científica, y que previenen, gestionan o mejoran el tratamiento de las enfermedades.
En 2019, Alemania abrió el camino en el reembolso de estas digital therapeutics con una estrategia clara ('Digitale Versorgung Gesetz' o DVG) estableciendo un sello de regulación propio ('DiGAs' [Digitale Gesundheitsanwendungen]) que, una vez conseguido , permite prescribir las apps de salud a cualquier persona cubierta por el seguro público alemán. Esta innovación en la adopción de tecnología está sirviendo de referente para otros países como Francia, Bélgica o UK que están desarrollando modelos propios.
Cataluña no se queda atrás y también trabaja en esta línea, de acuerdo con sus competencias dentro del marco estatal, y apuesta por contar con una autoridad notificadora que asesore y acompañe a las DTx de la BioRegión durante su proceso de integración dentro del sistema. “Una entidad neutra del sistema, como Biocat, podría acompañar a las startups digitales en el cumplimiento de los requerimientos asistenciales y regulatorios, agilizando y optimizando así el proceso final de evaluación por parte de AQuAS como agencia competente”, apunta Robert Fabregat, director general de Biocat.
Evaluación y financiación: principales retos de las DTx en Europa
El capital riesgo en la industria de DTx a nivel mundial aumentó de los 130 millones de dólares en 2015 a los 1.200 millones de dólares estadounidenses en 2019. La industria de las DTx está creciendo rápidamente, sobre todo en Estados Unidos, donde la FDA está alentando de forma proactiva estas terapias a través de su Centro de Excelencia de Salud Digital. Según Yolanda Puiggròs, abogada experta en salud y socia de Roca Junyent, Europa corre el riesgo de quedarse atrás por no funcionar como un mercado único ni disponer de un reconocimiento mutuo de la certificación o, en muchos casos, incluso de una evidencia clínica homogénea: "Ni tenemos una regulación específica ni un modelo de financiación que garantiza el acceso y la eficacia de estas aplicaciones digitales", explica en una sesión organizada por EIT Health Spain. "Lo que nos encontramos es un conjunto de normas que cubren en cierto modo los tres escalones del ciclo de vida de esta tecnología: la autorización, la evaluación y la financiación".
El primer escalón (la autorización) está resuelto con el marcado CE, que demuestra que el fabricante ha evaluado el producto y se considera que cumple con los requisitos de seguridad, sanidad y protección del medio ambiente exigidos por la Unión Europea. El segundo, el cuál hace referencia a la evidencia científica, en cambio, ya se plantea como un reto: la carencia de una normativa europea específica para estas terapias ocasiona que se sigan evaluando como en cualquier otro dispositivo médico. En España, la situación es aún más compleja porque la evaluación depende de cada comunidad autónoma.
Por último, también queda pendiente resolver quién y cómo se financian las terapias digitales. Es decir: ¿quién se hace cargo del reembolso a las empresas propietarias cuando se prescriben estas soluciones digitales? En este punto se proponen dos opciones: la primera, que el Estado o las aseguradoras sean los responsables de financiar el uso de estas tecnologías y, la segunda, que las soluciones se integren dentro del sistema mediante la compra pública de innovación. Sea como fuere, Yolanda Puiggròs propone que el mecanismo sea "ágil" para evitar que la tecnología quede en desuso antes de recibir la compensación económica.
El procedimiento alemán, pionero en regulación
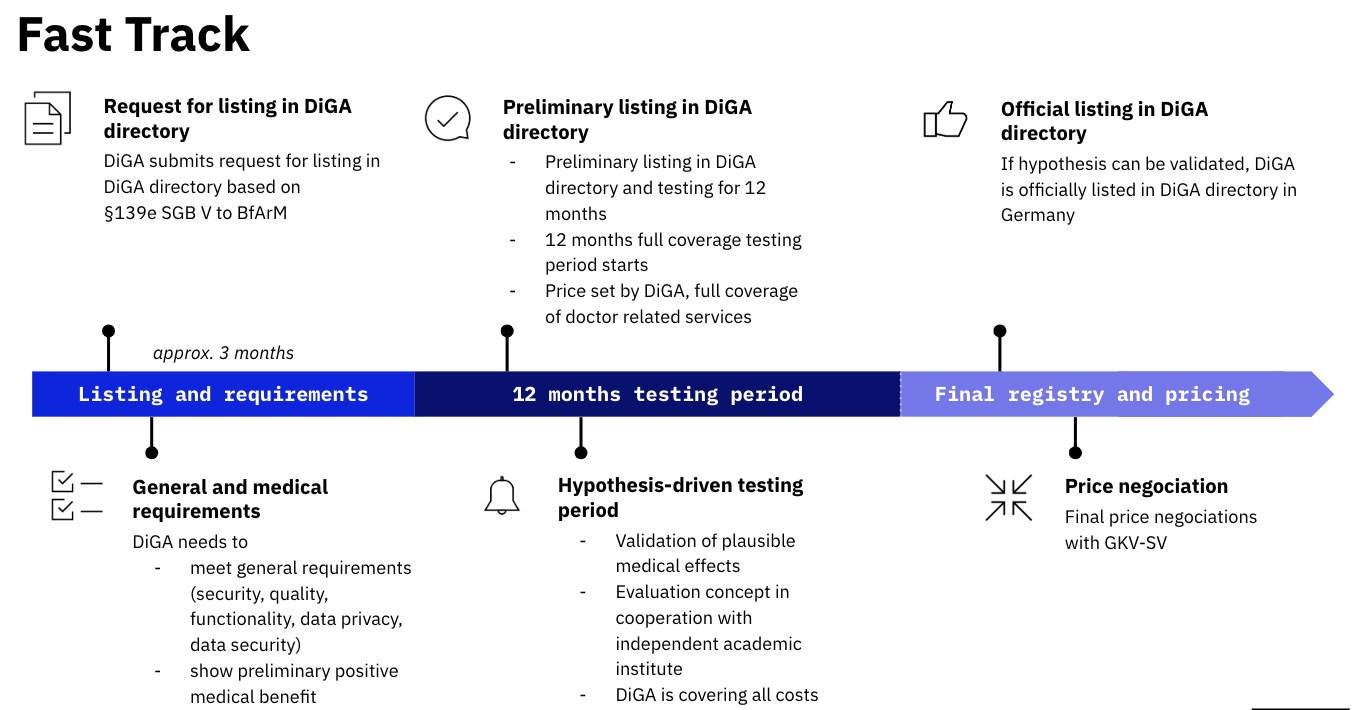
Alemania es el único país de la UE que dispone de un modelo a gran escala que permite a las empresas recibir aprobaciones y crear negocios sostenibles. El procedimiento alemán -DiGA Fast Track- permite a una compañía evaluar su solución en sólo tres meses. A continuación, la terapia digital obtiene una admisión provisional por su comercialización durante los siguientes 12 meses. Durante este período de un año la empresa deberá reunir las evidencias necesarias que demuestren la eficacia de su solución para poder entrar definitivamente en el directorio de DiGA.
"El paciente recibe un código cuando el médico le prescribe una terapia digital que le permite acceder a la solución mediante su compañía aseguradora o el sistema público. Una vez que el paciente ha solicitado su uso, es esta misma aseguradora quien financia directamente la empresa que ha desarrollado la solución", apunta Anne Sophie Geier, directora general de la Spitzenverband Digitale Gesundheitsversorgung, la entidad responsable de gestionar el DiGA.
Fuente: Digital Care Act: Is Germany now ready for #DigitalHealth?
Según explica Pablo Prieto, Chief Revenue Officer de Fosanis GmbH, compañía propietaria de MIKA, la primera DiGA para pacientes con cáncer, este modelo está todavía en sus inicios y habrá que ver si es rentable y aporta valor añadido. De hecho, ya han salido ciertas limitaciones, como el esquema ideado para su distribución, que no es idóneo para un público aún acostumbrado a las recetas en papel. También es mejorable la gestión de los pagos una vez que la aplicación se aprueba: "Con el acceso temporal se pasa a un modelo de precio libre que requiere negociaciones con cada una de las aseguradoras", afirma.
Actualmente en Alemania existen 2.780 aplicaciones móviles relacionadas con la salud, pero tan sólo 30 están registradas como DiGA. A mediados de este año, esperan llegar a las 50 aplicaciones con prescripción en el directorio.
Un país que se inspira en el planteamiento alemán es Francia. El presidente Macron anunció a finales de 2021 que quería un fast track para realizar las terapias digitales accesibles a los pacientes y que fueran reembolsables por el sistema de salud público. Según Nina Bufi, directora de proyectos eHealth del Ministerio de Salud, éste será un auténtico “punto de inflexión” para el sector sanitario francés, una auténtica “arma” para diversificar la oferta asistencial. Lo ha explicado durante su participación en la mesa redonda 'I'm a SME, where is my fast track?', organizada por Biocat, donde también ha avanzado que la estrategia tendrá una financiación de 650 millones de euros, dividida en cinco ejes. Esperan que las DTx puedan empezar a llegar a la población francesa a finales de 2023.
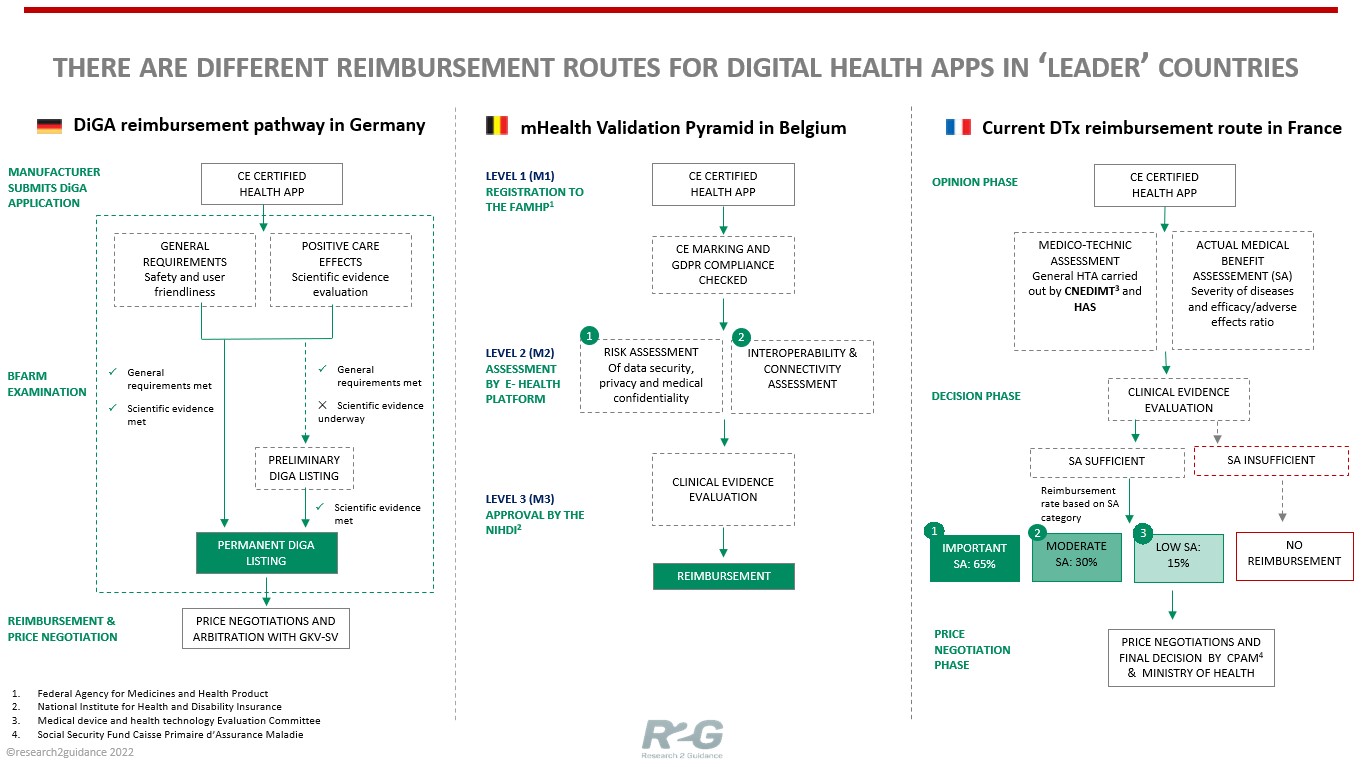
Por su parte, Bélgica también ha dado un paso adelante para hacer llegar las terapias digitales a los pacientes. La Agencia Federal de Medicamentos y Productos Sanitarios (FAMHP) se encarga de revisar las aplicaciones certificadas CE a partir de una pirámide de validación formada por tres niveles en los que se evalúa el riesgo, la interoperabilidad y la evidencia clínica. Actualmente, existen 34 apps de salud presentes en los niveles M1 y M2 de la pirámide de validación belga. Las aplicaciones que acaben llegando al tercer nivel recibirán un reembolso por parte del Instituto Nacional de Seguro de Salud y Discapacidad (NIHDI). En el siguiente gráfico se muestran los tres procesos de reembolso por las DTx que conviven actualmente en Europa.
Fuente: How to get your digital health app reimbursed in Europe? Start with Germany, Belgium and France
Una autoridad que acompañe a las DTx catalanas en su integración en el sistema
“Ojalá trabajáramos en la línea que ha diseñado Alemania y que ahora sigue Francia”, asegura Robert Fabregat, director general de Biocat, quien también apunta: “Es un buen punto de partida, aunque hay líneas de trabajo que se podrían mejorar, por ejemplo, adaptar la evaluación en función de la tipología de la tecnología. Se podría segmentar los procesos de evaluación en base al riesgo de la solución, estableciendo mecanismos más ágiles y laxos para las menos complejas”. Sin embargo, para Fabregat, la apuesta de la BioRegión debe ser la de contar con una autoridad notificadora que asesore y acompañe a las DTx catalanas durante su camino hacia la integración dentro del sistema, y Biocat podría tener un papel relevante en todo este proceso.
Por el momento, la compra pública de innovación es uno de los instrumentos facilitadores en la adopción de las innovaciones y el desarrollo de políticas tecnológicas y de innovación, y es el escogido por el Departamento de Salud de Cataluña para integrar la tecnología en el sistema. Así es como las soluciones digitales acaban formando parte de la caja de herramientas de los proveedores sanitarios mediante un esquema de licencia tradicional. Ramon Maspons, responsable de Innovación en AQuAS, revela que el sistema pone el foco en aquellas tecnologías que reúnen las siguientes características: servitización (convertir un producto en servicio), personalización, prevención y sostenibilidad. Pero avisa: "los nuevos mecanismos de colaboración entre el sector público y privado son una herramienta útil, pero es importante "tener claro qué entendemos por valor y qué estrategia seguimos para él".
Fuente: Informe de la BioRegión de Cataluña 2021
Biocat ha identificado en el Informe de la BioRegión 2021 a 30 compañías que pertenecen a la categoría DTx, clasificadas según si ofrecen una solución sobre autogestión y monitorización, prevención, tratamiento o genómica. Los criterios de selección han sido: la demostración de evidencia clínica (ya sea por la obtención del certificado de regulación europeo [EMA] o americano [FDA] o mediante un estudio piloto) y de impacto real y directo en el tratamiento de los pacientes.
Aprovecharemos la participación de algunas de estas compañías en 4 Years From Now (4YFN), el evento de referencia que reúne a las startups más innovadoras en Barcelona y donde han confirmado asistencia más de 60 startups healthtech de la BioRegión, para conocer de primera mano las propuestas de los emprendedores/as que las lideran y que recogeremos en el próximo post. ¡No te lo pierdas!